С.И. Жук, д.м.н, профессор, заведующая кафедрой акушерства и гинекологии медицины плода
Национальной медицинской академии последипломного образования им. П.Л. Шупика;
С.Н. Косьяненко, В.А. Кулик, Центр матери и ребенка, г. Винница
В работе практикующего гинеколога достаточно часто встречается сочетание гинекологической патологии и заболеваний молочных желез (МЖ) [1, 3, 7, 9]. Согласно современным концепциям, МЖ, так же как и матка, представляют собой органымишени для половых стероидных гормонов и находятся под их влиянием. Учитывая это, актуальным является изучение влияния гормональных препаратов, в т. ч. и комбинированных оральных контрацептивов (КОК), на состояние МЖ при использовании данных лекарственных средств для лечения гиперпластических процессов эндо- и миометрия, а также профилактики и лечения дисгормональной дисплазии МЖ (ДДМЖ) [2].
Комбинированная оральная контрацепция существует уже более полувека и является наиболее эффективным методом предохранения от беременности. Она обладает высокой эффективностью, безопасностью, а также целым рядом дополнительных преимуществ, позволяющих использовать КОК для профилактики и лечения некоторых гинекологических и экстрагенитальных заболеваний.
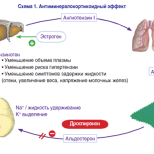
Гестагенное влияние комбинированных препаратов значительно превышает эстрогенное. Противозачаточное действие КОК обусловлено именно гестагенным компонентом. Роль эстрогенов заключается в потенцировании действия прогестинов благодаря усилению экспрессии рецепторов прогестерона, что позволяет снизить дозу прогестагена в КОК и в контроле менструального цикла. Входящий в состав этинилэстрадиол замещает эффекты эндогенного эстрадиола, поскольку синтез последнего во время приема КОК минимален.
Лечебные свойства КОК объясняются следующими механизмами:
● торможением секреции гонадотропных гормонов гипофиза, фолликулогенеза и стероидогенеза в яичниках;
● подавлением пролиферации эндометрия, митотической активности миометрия и клеток МЖ;
● влиянием на процессы межклеточного и внутриклеточного взаимодействия.
Все это в совокупности обеспечивает на время использования препаратов так называемый «покой» репродуктивной системы, крайне полезный для ее полноценного функционирования. Многие исследователи сходятся во мнении о протективном действии КОК в отношении доброкачественных заболеваний и рака МЖ [7, 9]. При длительном применении низкодозированных КОК частота ДДМЖ снижается на 40%.
Это связано с обеспечением функционального покояосновных структур МЖ [4, 9]. Терапия гиперпластических процессов репродуктивной системы (ГПРС) женщин остается одной из актуальных проблем в гинекологической и маммологической практике. В проведенных нами исследованиях сочетанная патология гиперпластического характера в эндометрии, миометрии, яичниках и МЖ выявлена почти у каждой второй пациентки (69,9 %).
При этом важной причиной возникновения диспластических заболеваний МЖ является нарушением баланса половых стероидов – эстрогенов и прогестерона – в результате чего развивается относительная гиперэстрогения (ГЭ). Это приводит к пролиферации эпителия альвеол, протоков, усилению активности фибробластов с пролиферацией соединительной ткани МЖ и последующим образованием кист.
В результате проведенных исследований установлено, что определенная гинекологическая патология проявляется в большинстве случаев характерными изменениями в структуре МЖ. А состояние МЖ – это гормональное зеркало женского организма. Поэтому подбор гормонального лечения всегда должен проводиться индивидуально, с учетом выявленной гинекологической патологии и изменений в МЖ, гормонального статуса и конституциональных особенностей пациентки.
Также необходимо учитывать различную направленность действия гестагенного компонента, содержащегося в КОК. Так как все оральные контрацептивы в качестве эстрогенного компонента содержат этинилэстрадиол, то гестагенный компонент в их структуре различен. В спектре активности гестагена необходимо учитывать не только его собственный гестагенный эффект, но и дополнительное влияние обусловленное наличием или отсутствием антиэстрогенной, андрогенной, антиандрогенной, глюкокортикоидной, антиминералокортикоидной активности. О наличии указанных эффектов гестагенов в сравнении с прогестероном судят по их способности ингибировать или активировать определенные внутриклеточные рецепторы эстрогенов, андрогенов, глюкокортикоидов и т.д.
В последнее время практикуется новый подход к назначению КОК. Пациенткам, которые не желают появления ежемесячных менструаций имеющих выраженную дисменорею, дисфункциональные кисты яичников или подозрение на малые формы наружного эндометриоза, можно рекомендовать так называемый «сезонный» режим назначения КОК (непрерывный прием препарата в течение 63 дней, затем перерыв в 7 дней). Длительные схемы дозирования могут также упростить прием КОК, поскольку уменьшение количества перерывов снижает риск пропуска таблеток, что в конечном счете повышает контрацептивную эффективность метода [2, 6, 7].
У женщин с функциональными кистами яичников, эндометриозом, гиперполименореей и дисменореей пролонгированный режим приема КОК дает дополнительные преимущества и позволяет значительноповысить качество жизни. У больных сахарным диабетом такой режим приема препаратов способствует уменьшению колебаний уровня глюкозы в крови. Более редкие менструальные кровотечения могут оказать профилактическое и терапевтическое влияние при железодефицитных анемиях [6, 7].
Состояния, при которых рекомендуется прием КОК в пролонгированном режиме:
1. Гинекологическая патология: эндометриоз, предменструальный синдром, гиперполименорея, дисфункцио нальные маточные кровотечения, фолликулярные и лютеиновые кисты яичников, синдром поликистозных яичников, дисменорея, гиперандрогенные состояния.
Применение препаратов на фоне хирургического лечения заболеваний шейки матки (диатермокоагуляция и др.).
2. Экстрагенитальные заболевания: анемия, гемофилия, геморрагический диатез, «менструальная» мигрень и др. [4, 6, 7].
Однако окончательно решить проблему приемлемости пролонгированного режима приема КОК возможно только на основании новых уточненных данных об эффектах подобной схемы и, как следствие, безопасности ее применения.
Целью работы явилось изучение эффективности и безопасности применения препарата Линдинет 20 в пролонгированном режиме (непрерывно 63 дня, затем перерыв в 7 дней с последующим циклическим приемом), особенности их влияния на гормональные и клинические показатели, эффективность профилактики развития рецидивов гиперпластических процессов МЖ и функциональных кист яичников у женщин репродуктивного возраста.
Материалы и методы исследования
Для решения поставленной задачи нами были обследованы 86 женщин в возрасте от 22 до 38 лет, которые впервые начали прием КОК. В основную группу вошли 56 пациенток с диспластическими заболеваниями МЖ (ДДМЖ) на фоне гинекологической патологии (функциональные кисты яичников). Контрольную группу составили 30 женщин без гинекологической патологии и заболеваний МЖ. Пациентки обеих группы получали терапию и контрацепцию препаратом Линдинет 20 в пролонгированном режиме.
Анамнез обследуемых женщин изучали по разработанной нами анкете. Особое внимание уделяли перенесенным экстрагенитальным заболеваниям и наследственности – гинекологической, маммологической и онкологической патологии у ближайших родственников. Были выполнены вагинальное УЗИ и лабораторное исследование. Определяли уровень гормонов (прогестерона, эстрадиола, пролактина, тестостерона, дегидроэпиандростерона [ДГЭАС], тиреотропного гормона [ТТГ], трийодтиронина [Т3], тироксина [Т4]) и онкомаркеров МЖ. Состояние МЖ оценивали с учетом жалоб пациенток, на основании клинического исследования (пальпации) и данных УЗИ МЖ, допплерографии, цитологического исследования выделений из сосков, а также проведенной (по показаниям) пункционной биопсии кист МЖ.
Пациенток с узловыми формами мастопатии, фиброаденомами, установленной гиперпролактинемией в исследование не включили; им было назначено лечение в соответствии с выявленной патологией. Параллельно проводили терапию заболеваний щитовидной железы.
Для лечения гинекологической и маммологической патологии был выбран препарат Линдинет 20. Выбор основывался на том, что данный КОК является низкодозированным (содержит 20 мкг этинилэстрадиола) и имеет в составе уникальный прогестаген – гестоден. По сравнению с другими прогестагенами 3-го поколения гестоден по своей химической структуре наиболее близок к натуральному прогестерону. Кроме того, гестоден обладает выраженными антиэстрогенными свойствами, что помогает нейтрализовать нежелательные метаболические эффекты эстрогенов. По данным ряда авторов (Асецкая И.Л., Белоусов Ю.Б., 2001; Colletta A.A. et al., 1991), стимуляция эстрогеновых рецепторов рассматривается как фактор риска развития рака МЖ. При сравнительном исследовании способности различных гестагенов изменять активность α- и β-эстрогеновых рецепторов в культуре клеток СOS-7 обнаружено, что норэтистерон, норэтинодрел и дезогестрел стимулируют α-эстрогеновые рецепторы, а норгестрел, левоноргестрел, норэтистерон и норэтинодрел – β-эстрогеновые рецепторы.
Гестоден – это единственный прогестаген, который не обладает способностью стимулировать активность α- и β-эстрогеновых рецепторов в культуре клеток.
В то же время он подавляет экспрессию эстрогеновых рецепторов в клетках-мишенях, тем самым предотвращая чрезмерную стимуляцию этих клеток эстроге нами. Таким образом, выраженное антиэстрогенное свойство гестодена, входящего в состав Линдинета 20, подтверждает целесообразность назначения этого КОК при ДДМЖ. В отличие от других гестагенов 3-го поколения гестоден не подвергается метаболизму при первичном прохождении через печень, и его биодоступность составляет 100%. Имеются также данные о дозозависимом тормозящем влиянии гестодена на рост клеток рака МЖ, однако для дальнейшего изучения этого вопроса необходимо проведение дополнительных клинических испытаний.
Клиническое исследование проводили до назначения КОК, а также через 3 и 6 мес на фоне их приема.
Результаты исследования и их обсуждение
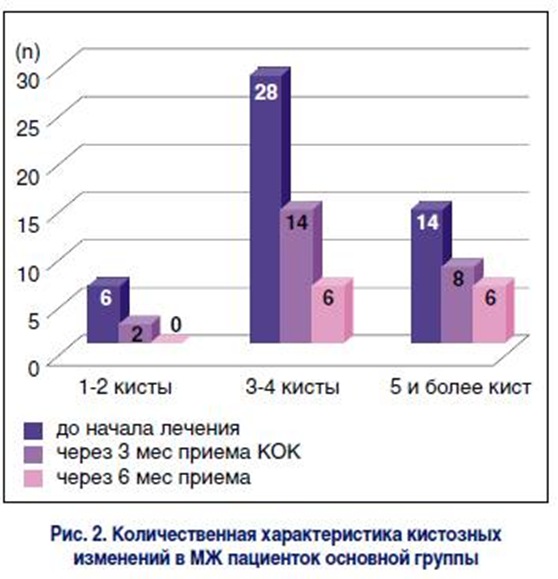
До начала лечения 47 (83,9%) женщин отмечали нагрубание, выраженные болезненные ощущения в МЖ не только за 5-7 дней до менструации, но и в середине менструального цикла (рис. 1). Выделения из сосков выявлены у 21 (37,5%) пациентки, а наличие пальпируемых уплотнений в паренхиме МЖ – у всех 56 обследуемых.
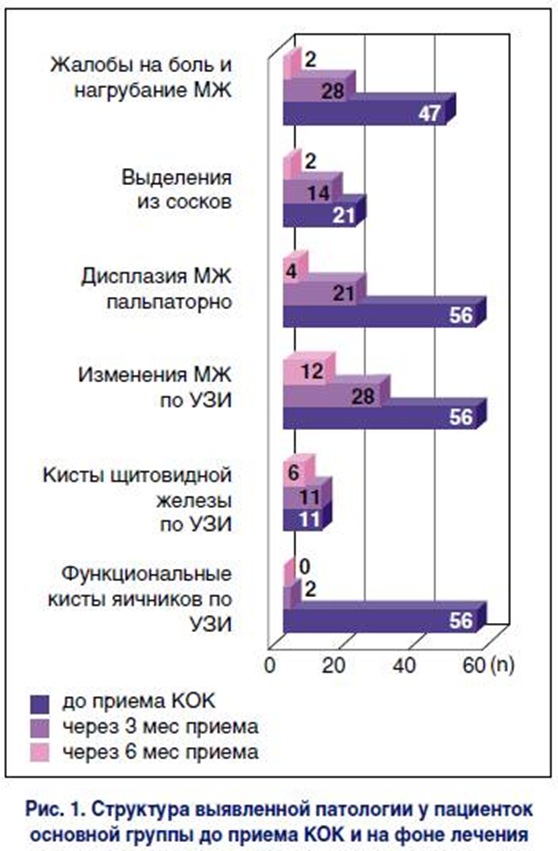
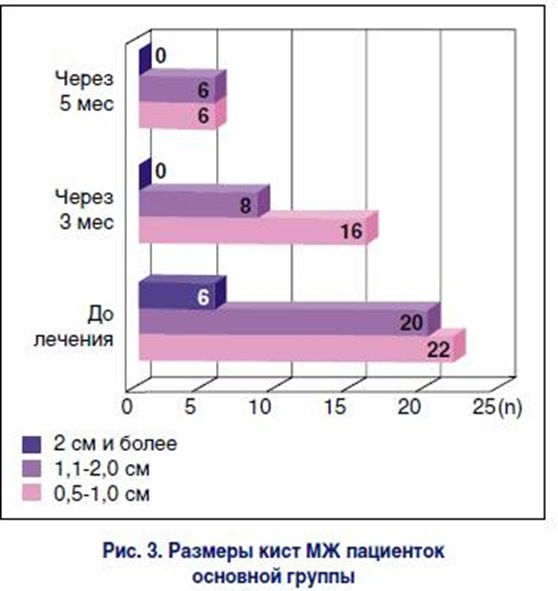
При проведении УЗИ кистозная форма ДДМЖ обнаружена у 48 (85,7%) пациенток (размеры и количество выявленных кист указаны на рис. 2, 3), при этом у 6 (10,7%) женщин преобладал аденоз МЖ. Кисты щитовидной железы до 1 см в диаметре наблюдались при скрининговом обследовании у 11 (19,6%) пациенток. У всех участниц основной группы диагностировали функциональные кисты яичников (преимущественно фолликулярные) размером до 6 см (рис. 1).
Кисты МЖ размером 2,3 ± 0,4 см были выявлены у 6 (10,7%) пациенток основной группы. До назначения Линдинета 20 им была проведена пункционноаспирационная биопсия (ПАБ) под контролем УЗИ, с полным извлечением содержимого. Пролиферативных или атипических изменений при цитологическом исследовании пунктата и выделений из сосков у женщин не обнаружено.
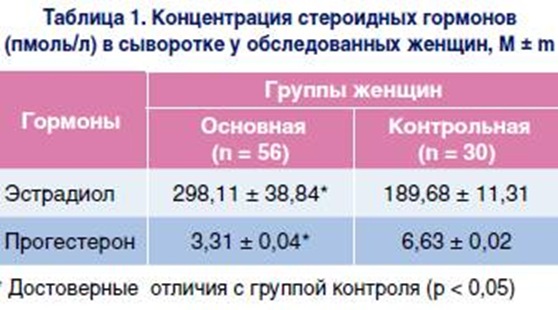
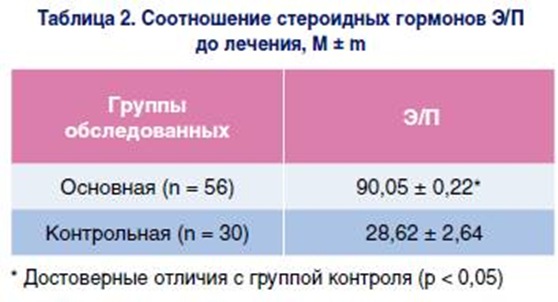
В процессе анализа результатов исследования у пациенток до лечения нами обнаружена прямая взаимосвязь между интенсивностью масталгии и уровнем эстрадиола в крови на 5-7-й день (r = 0,30; р < 0,01) и 20-23-й день цикла (r = 0,37; р < 0,001), а также величиной отношения эстрадиол/прогестерон (Э/П) (r = 0,3; р < 0,05). Так, у больных с наличием масталгии по сравнению с лицами без болевого синдрома (контрольная группа) содержание в крови эстрадиола было большим (табл. 1). Концентрация эстрадиола в крови у пациенток с масталгией на 5-7-й день цикла составляла 298,11 ± 38,84 пмоль/л, а на 20-23-й день – 702,02 ± 92,81 пмоль/л, в то время как у пациенток без этого симптома – 189,68 ± 11,31 и 356,4 ± 24,57 пмоль/л соответственно (р < 0,001). Отношение Э/П у лиц с болезненностью МЖ составило – 90,05 ± 0,22, а у женщин без болевого синдрома – 28,62 ± 2,64 (р < 0,05) (табл. 2).
Таким образом, величина Э/П в крови пациенток основной группы до лечения была в 3,1 раза больше посравнению с аналогичным показателем в контроле, что указывало на существующий гормональный дисбаланс у этих лиц.
Анализ данных обследования пациенток с ГЭ показал, что применение Линдинета 20 в пролонгированном режиме было эффективным и безопасным и сопровождалось регрессом основной клинической симптоматики (рис. 1), уменьшением объема яичников и толщины эндометрия, нормализацией менструального цикла по окончании лечения и эффективным снижением уровня эстрогенов в крови.
Жалобы на боль и нагрубание МЖ через 3 мес отмечали всего 18 (32,1%) женщин, а выделения из сосков14 (25%). Пальпаторные проявления ДДМЖ были обнаружены у 21 (37,5%) пациентки, при этом рецидивов кист МЖ диаметром > 2 см не выявлено ни у одной из участниц исследования. Кисты яичников диагностированы только у 2 (3,6%) женщин.
Через 6 мес приема препарата Линдинет 20 у 54 пациенток (96%) отсутствовали боли в МЖ, чувство распирания в предменструальный период, а на масталгию жаловались только 2 (3,6%). Улучшилось и общее состояние пациенток – они ощущали прилив сил, у них нормализовался нервно-психический статус. Все эти изменения придавали женщинам уверенность в правильности выбора препарата.
Через 3 мес терапии у 78% пациенток при УЗИ МЖ выявлено снижение плотности железистого и фиброзного компонентов за счет уменьшения участков гиперплазированной ткани. Также отмечалось уменьшение количества и размеров кист у 41,7% женщин (рис. 2 и 3). Дуктэктазии наблюдались только у 14% пациенток.
Через 6 мес от начала приема Линдинета 20 кисты МЖ размером до 2 см обнаруживали только у 12 (21,4%) женщин основной группы. Рецидивов крупных кист, которые были пунктированы до назначения КОК и вновь образованных, выявлено не было.
У женщин контрольной группы после шестимесячного приема препарата не было выявлено кист яичников и отсутствовали признаки ДДМЖ. При УЗИ эндометрия через 6 мес от начала приема Линдинета 20 средняя величина М-эха составляла 6,8 ± 0,4 мм и 7,1 ± 0,2 мм соответственно в основной и контрольной группах.
Функциональные кисты яичников не были обнаружены у пациенток обеих групп.
Представленная схема приема КОК, кроме контрацептивного, оказывает дополнительный лечебный эффект путем минимизации колебаний гормонального уровня. Это позволяет устранить следующие негативные симптомы: нервозность, раздражительность, изменения настроения, нарушение концентрации внимания, отечность, головную боль, нагрубание МЖ и т.д., что улучшает качество жизни женщин.
Таким образом, препарат Линдинет 20, содержащий 20 мкг этинилэстрадиола и 75 мкг гестодена, в пролонгированным режиме приема является эффективным контрацептивным средством у пациенток, которые впервые начинают использовать КОК, страдают диффузной ДДМЖ, преимущественно кистозной формы в сочетании с гинекологической патологией (наличие функциональных кист яичников).
Выводы
● Проведенное исследование свидетельствует, что выраженное положительное влияние Линдинета 20 на течение ДДМЖ объясняется не только свойствами гестагена, но и приемом препарата в пролонгированном режиме, что позволяет избежать колебания уровня гормонов и связанных с этим негативных симптомов.
● Оптимальным способом лечения гинекологической патологии, сочетанной с ДДМЖ (наличие крупных [> 2 см] кист МЖ) у женщин репродуктивного возраста, которые впервые начинают прием КОК, является ПАБ кист МЖ с последующим приемом Линдинета 20 в пролонгированном режиме. Данная тактика показана при отсутствии пролиферативных и атипических изменений по результатам цитологического исследования пунктата и выделений из сосков.
● Интенсивность масталгии у пациенток с ДДМЖ имеет прямую зависимость с уровнем эстрадиола в крови и соотношением Э/П.
● Эффективность предложенной пролонгированной схемы лечения через 3 мес приема Линдинета 20 составила 63,4%, через 6 мес – 87,6%.
Литература
1. Дубоссарская З.М., Дубоссарская Ю.А. Гормональная контрацепция и некоторые лечебные эффекты / З.М. Дубоссарская, Ю.А. Дубоссарская // Здоровье женщины. – 2009. – № 3.
2. Жук С.И., Захурдева Л.Д. Психологические особенности женщины в основе конституционального подбора КОК / С.И. Жук, Л.Д. Захурдева // Медицинские аспекты здоровья женщины. – 2009. – № 1(18).
3. Успенский Д.А., Ласачка С.А. К вопросу о тактике ведения пациенток с кистами молочных желез в поздний репродуктивный и перименопаузальныйй период / Д.А. Успенский, С.А. Ласачка // Новости медицины и фармации. – 2009. – № 298. – С. 51-54.
4. Успенский Д.А., Сухина Н.А. Уточняющая диагностика узловых образований молочных желез на современном уровне / Д.А. Успенский, Н.А. Сухина // Новости медицины и фармации. – 2009. – № 298. – С.21-23.
5. Филиппов О.С. Доброкачественные заболевания молочных желез / О.С. Филиппов. – М.: Медпресс-информ, 2008.
6. Пухлиноподібні ураження яєчників (діагностика та лікування): методичні рекомендації. – К., 2007.
7. Наказ МОЗ України № 676 від 31.12.2004 р. «Про затвердження клінічних протоколів з акушерської та гінекологічної допомоги». – К., 2004. – С. 160-169.
8. Татарчук Т.Ф., Сольский Я.П. Эндокриння гинекология (клинические очерки) / Т.Ф. Татарчук, Я.П. Сольский. – К., 2003. – Ч. 1. – С.147-180.
9. Прилепская В.Н., Швецова О.Б. Доброкачественные заболевания молочных желез: принципы терапии / В.Н. Прилепская, О.Б. Швецова // Гинекология. – 2000. –Т. 2, №6. – С. 201-204.
Рубрика Контрацепция, Статьи и публикации






Отзывов нет
Комментариев пока нет.
Оставьте свой отзыв