С.И.Жук, Е.А. Ночвина, С.Н. Косьяненко
Украинская военно-медицинская академия
Винницкий национальный медицинский университет им. Н.И. Пирогова
«Центр матери и ребенка» г. Винница
Резюме. Проблема рациональной антибиотикотерапии гинекологических больных остается серьезным вопросом клинической медицины. Женское микроэкологическое здоровье в значительной степени формирует здоровье новорожденных и человеческого общества в целом. Широко практикуемая в акушерско-гинекологической практике массивная антимикробная терапия может вызывать микроэкологические нарушения во всем организме, что лишает мочеполовую систему и другие биотопы естественной колонизационной резистентности. Схемы комплексной терапии гинекологических больных должны учитывать тесную взаимосвязь влагалищного и кишечного биоценозов и включать в себя препараты для коррекции микробиологических нарушений в этих биотопах. В данной статье представлено изучение эффективности препарата «Гинофорт» компании «Гедеон Рихтер Рт» для коррекции микробиоценоза влагалища в комплексе лечения воспалительных заболеваний различных отделов женского полового тракта.
Наиболее актуальным вопросом одной из самых дискуссионных проблем современной медицины и микробиологии является микробная экология человека. В процессе эволюции сложилась взаимовыгодная форма симбиоза между макроорганизмом и селективно отобранными наиболее полезными для него микробными популяциями, заселившими все открытые биологические системы человека. Благодаря выработке специфических адаптационных механизмов, микрофлора человека не только участвует в метаболических, регуляторных и генетических механизмах жизнедеятельности, но и создает мощную защиту от вторжения чужеродных микроорганизмов из внешней среды. По последним данным, касающимся микробиологических исследований (1) только бактерий насчитывается около 100 тыс. видов, из которых 3 тыс. являются патогенными для человека. Кроме того, следует учитывать, что при разрушении взаимовыгодных симбиотических отношений между микроорганизмом и его микрофлорой, микробный компонент способен трансформироваться из симбионта в эндогенного агрессора с высоким вирулентным потенциалом.
Специфика расселения различных микробных популяций по определенным биотопам макроорганизма коррелирует со сложившимися там условиями для обитания микроорганизмов. Наиболее густо заселенной экосистемой является толстая кишка, в которой сконцентрировано около 60% микрофлоры человека, 15-16% микроорганизмов находятся в ротоглотке, 15-20% заселяют кожные покровы. В вагинальном биотопе у женщин содержится 9-10% микрофлоры макроорганизма (1). Все локальные микроэкосистемы тесно взаимодействуют между собой, а возникновение дисбиоза в одной из них непременно отражается на качественном и количественном составе микрофлоры в других микробных нишах.
Причины дисбиотических расстройств очень разнообразны. Известно, что на микроэкологию человека влияет характер питания, возраст, время года, окружающая среда, а также состояние эндокринной и иммунной систем организма человека. Широко применяемые с целью антимикробной защиты человека химиопрепараты, особенно антибиотики, подавляют иммунитет и вызывают возникновение дисбиотических расстройств.
Проблема рациональной антибиотикотерапии гинекологических больных остается одним из самых сложных вопросов клинической медицины. В современных условиях этиология приктически всех инфекционных заболеваний половых органов характеризуется наличием смешанной флоры. Даже в случае экзогенных урогенитальных инфекций, обусловленных конкретным патогенным микробом, к нему быстро присоединяется эндогенная условно-патогенная флора нижних отделов половых путей.
К числу заболеваний женской половой сферы, которые требуют применения антибактериальной терапии относятся воспалительные процессы нижнего отдела урогенитального тракта, а также органов малого таза. На долю этой патологии приходится 55-70% в структуре гинекологической заболеваемости, из которых 40-50% занимают вагинальные инфекции и инфекции шейки матки (2). В качестве лекарственных средств применяются вещества с антибактериальной, бактерицидной, антисептической, дезинфицирующей активностью. Противовоспалительное лечение (включая и антибактериальное) делят на эндосоматическое (парентеральное введение антибиотиков) и эписоматическое (показано при интактных и поврежденных кожных покровах и видимых слизистых оболочках). Таким образом, антибактериальное лечение при наличии воспалительных изменений в гениталиях может носить общий и местный характер (3). Особенностью антибактериальной терапии гинекологических больных является ее антианаэробная направленность, поскольку именно анаэробам приписывается наибольшее этиологическое значение в развитии большинства воспалительных заболеваний гениталий. Однако следует учитывать, что любое гинекологическое заболевание протекает в ассоциации с вагинальным дисбиозом, а интенсивная антибактриальная терапия с прессингом на анаэробную флору значительно усложняет дисбиотические расстройства не только во влагалище, но и в других биотопах организма. Таким образом, одним из важнейших этапов в лечении воспалительных заболеваний урогенитального тракта является терапия, направленная на сохранение или восстановление аутофлоры макроорганизма.
С целью коррекции вагинального микробиоценоза наиболее часто предлагаются бактерийные препараты кислотопродуцирующей группы, действующим началом которых являются живые культуры бифидо- и лактобактерий различного видового состава, однако многие из представленных препаратов наиболее активны в отношении стрептококков В и стафилококков, а также ентеробактерий родов Proteus, Esherichia, Citrobacter, но мало активны в отношении грибов рода Сandida (4). На практике мы часто наблюдаем возникновение клинических симптомов кандидозного вульвовагинита, а также появление спор грибов рода Candida при микроскопии нативных мазков влагалищных выделений, рост колоний грибов при микробиологическом их исследовании после применения препаратов, направленных на коррекцию микрофлоры влагалища.
Принимая во внимание данный факт, можно предположить возможность стимуляции роста грибов рода Candida, как компонента симбионтной микрофлоры, на фоне заселения влагалища бактериями группы Doderlein.
Целью нашего исследования является изучение клинических особенностей использования препарата «Гинофорт» (компания «Гедеон Рихтер Рт.», Венгрия) для коррекции биоценоза влагалища после лечения воспалительных заболеваний нижних отделов урогенитального тракта и органов малого таза.
Материалы и методы.
С целью решения поставленной задачи нами было обследовано 160 женщин после проведенной общепринятой эндо- и эписоматической антибактериальной, противовоспалительной терапии по поводу воспалительных заболеваний различных отделов женской половой сферы. Для изучения качественного и количественного состава микрофлоры использовались микроскопический и бактериологический методы исследования влагалищного содержимого, измерение рН влагалища, а также обязательное проведения посева кала на питательные среды для идентификации кишечного биотопа.
Таблица 1. Состав нормальной микрофлоры толстокишечного биотопа.
|
Микроорганизмы |
Количество клеток микроорганизмов в 1 г содержимого толстой кишки |
|
Анаэробная ассоциация, % Bifidobacterium Lactobacillus Propionibacterium Бактероиды Peptostreptococcus Clostridium Eubacterium Аэробная ассоциация, % Еsherichia: - лактозосбраживающие - атипичные Enterococcus Staphylococcus Proteus Дрожжи и дрожжеподобные грибы |
95-97% 109- 1012 107-1010 107-1010 105-1010 105-106 102-105 105-107 3-5% 106-108 не более 103 105-107 103-105 не более 103 102-104 |
Таблица 2.
Нормальный состав вагинального нормобиоценоза женщин репродуктивного возраста.
|
Группа микроорганизмов
|
Количество клеток в 1 мл секрета |
|
Анаэробная микрофлора Lactobacillus Bifidobacterium Propionibacterium Clostridium Eubacterium Peptostreptococcus Бактероиды Peptococcus Veillonella Аэробная и факультативно- анаэробная микрофлора Corynebacterium Staphylococcus Streptococcus Esherichia Klebsiela |
108-109 105-107 104-106 не более 103 не более 103 103-104 не более 103 не более 103 не более 103 не более 103 103-104 104-105 103-104 не более 103 |
Обоснованием назначения препарата «Гинофорт» являются следующие его свойства: действующее вещество препарата – бутоконазола нитрат — блокирует в клеточной мембране грибов рода Candida, Trichophyton, Microsporum образование эргостерола, увеличивает проницаемость мембраны, что приводит к постепенному снижению колонизационной и адгезивной активности гриба и его гибели. В результате создаются условия для конкурентного взаимодействия эндогенных лакто- и бифидобактерий, обладающих высокой адгезивной активностью со слизистой оболочкой влагалища. Прикрепляясь к эпителиоцитам, бактерии группы Doderlein, покрывают стенку влагалища сплошным слоем и препятствуют адгезии других микроорганизмов, обеспечивая тем самым колонизационную активность. Преимуществом препарата «Гинофорт» является кратность его применения. На удобство однократного введения аппликатора акцентировали внимание женщины, которые на протяжении 10-14 дней регулярно использовали различные местные формы антибактериальных, антисептических препаратов в комплексе лечения воспалительных заболеваний гениталий. При однократном интравагинальном введении бутоконазол находится на слизистой влагалища 4-5 дней.
Учитывая тесную взаимосвязь влагалищного и кишечного биотопов, проводилась обязательная коррекция микроэкологических нарушений кишечного биотопа женщины.
Результаты исследования и их обсуждение.
Средний возраст обследуемых женщин составлял 18-40 лет.
Все женщины были разделены на две группы по 80 человек каждая.
В первой (основной) группе женщин восстановление микробиоценоза влагалища после лечения воспалительных заболеваний различной локализации проводилось препаратом «Гинофорт» — однократное интравагинальное введение аппликатора в любое время суток. Во второй контрольной группе женщин использовались различные предлагаемые на сегодняшний день традиционные препараты для местного применения с целью коррекции влагалищного биотопа.
Обязательно проводилась в обеих группах женщин параллельная коррекция микрофлоры кишечника пероральным применением различных пробиотиков.
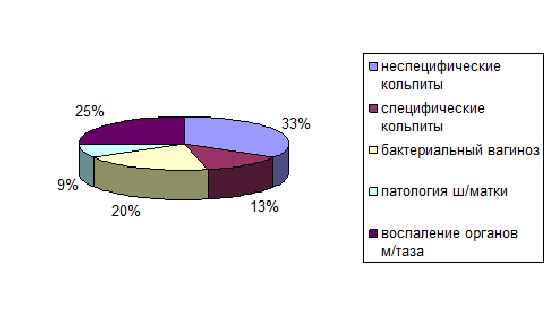
Структура патологии различных отделов женских половых органов представлена на рис.1: кольпиты неспецифической этиологии диагностировались у 54(33%) женщин, кольпиты специфические – у 20(13%), бактериальный вагиноз встречался у 32(20%) женщин, воспалительные заболевания шейки матки (цервициты, эндоцервициты, в т.ч. специфической этиологии) наблюдались у 14(9%) пациенток, воспалительные заболевания органов малого таза – у 40(25%).
Рис.1. Структура заболеваний различных отделов гениталий у обследованных женщин (n=160)
рН влагалища, микроскопический и микробиологический анализ состава влагалищного биотопа, культуральное исследование микрофлоры кишечника проводилось до и после применения препаратов, направленных на коррекцию микрофлоры
Таблица 3.
Уровень рН у обследованных женщин до и после лечения (n=160)
|
Значение рН |
Количество женщин, абсолютное число |
|||
|
Основная группа (n=80) |
Контрольная группа (n=80) |
|||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
более 6,1 |
5 |
0 |
7 |
2 |
|
5,6-6,0 |
12 |
0 |
13 |
4 |
|
5,1-5,5 |
18 |
3 |
20 |
10 |
|
4,7-5,0 |
35 |
7 |
32 |
24 |
|
3,5-4,6 |
10 |
70 |
8 |
40 |
При микробиологическом исследовании влагалищных выделений у обследованых женщин наблюдалось снижение количества или отсутствие лактобацилл, рост численности колоний анаэробной флоры влагалища с преобладанием так называемых БВ-ассоциированных микроорганизмов, у всех женщин диагностирован рост колоний факультативных аэробных организмов. При анализе бактерийных карт фекалий выявлены признаки микроэкологического дисбаланса: снижение содержания бифидобактерий менее 10 8 КОЕ/г, снижение содержания лактобацилл менее 106 КОЕ/г, увеличение содержания эшерихий более 108 КОЕ/г, появление эшерихий с измененными свойствами в количестве более 10% от их общего числа, обнаружение энтерококков в количестве более 106 КОЕ/г, появление микрофлоры с гемолитическими свойствами.
Микробиологическая картина влагалищного содержимого до и после применения препарата «Гинофорт» с целью коррекции биоценоза представлена в таблице 4.
Таблица 4.
Состав влагалищного микробиоценоза у обследованных женщин до и после лечения
|
Микроорганизмы |
Частота выделения, % |
|||
|
Основная группа, (n=80) |
Контрольная группа, (n=80) |
|||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
Lactobacillus |
41,3 |
97,9 |
40,8 |
66,3 |
|
Bifidobacterium |
10,5 |
88,4 |
11,2 |
11,0 |
|
Propionibacterium |
0 |
66,3 |
0 |
0 |
|
Enterococcus |
32,8 |
12,7 |
35,5 |
41,2 |
|
Esherichia |
66,7 |
18,4 |
70,2 |
56,4 |
|
Proteus |
19,4 |
0 |
23,3 |
21,5 |
|
Enterobacter |
21,6 |
0 |
25,0 |
18,9 |
|
Staphylococcus |
58,8 |
8,2 |
49,7 |
50,3 |
|
Corynebacterium |
42,5 |
57,5 |
52,6 |
55,0 |
|
Peptostreptococcus |
33,8 |
16,9 |
27,2 |
10,8 |
|
Gardnerella |
35,4 |
9,4 |
56,3 |
55,7 |
|
Bacteroides |
86,4 |
15,5 |
81,7 |
60,4 |
|
Candida |
7,8 |
2,5 |
46,8 |
46,0 |
|
Mobilincus |
27,6 |
0 |
24,9 |
12,7 |
При анализе результатов микробиологического исследования состава влагалищных выделений в контрольной группе обращает на себя внимание наличие спор грибов рода Candida у 37(46%) женщин, у 12 из них появились клинические симптомы урогенитального кандидоза. У 10 из 80 женщин контрольной группы (8%), у которых не было указаний на кандидоз (клинически и микробиологически) появились споры гриба Candida.
В основной группе лишь у 2 женщин при микроскопическом исследовании мазков влагалищных выделений выявлены споры грибов, что подтверждалось ростом колоний на питательной среде.
Анализируя микробиологические данные, полученные в ходе исследования, напрашивается вывод о возможности активизации урогенитального кандидоза после использования бактерийных препаратов кислотопродуцирующей группы, содержащих культуры бифидо- и лактобактерий. Субстратом для роста бактерий группы Doderlein является гликоген, который с их помощью метаболизируется в глюкозу. А повышенное содержание глюкозы, которое возникает при применении препаратов живых культур лакто- и бифидобактерий, благоприятствует диссеминации Candida и является одним из лучших источников углерода для последних.
Выводы.
Комплексная терапия воспалительных заболеваний различных отделов женской половой системы должна включать в себя восстановление кишечного и вагинального эубиоза. Однако, большинство неудач на данном этапе лечения обусловлено неспособностью многих пробиотических бактерий успешно конкурировать in vivo с условно-патогенной флорой и надолго приживляться во влагалище.
В представленном исследовании мы доказали эффективность применения препарата «Гинофорт» компании «Гедеон Рихтер Рт.» с целью коррекции влагалищного биотопа в комплексе терапии воспалительных заболеваний гениталий. Данный эффект основывается на подавлении роста грибов рода Candida, как компонента симбионтной микрофлоры, активизация которого возможна при лечении воспалительных заболеваний гениталий. Препарат «Гинофорт», воздействуя на Candida, обуславливает активизацию адгезии и конкурентную колонизацию бактерий группы Doderlein во влагалище, тем самым восстанавливая эубиоз данного биотопа.
Так как значимость нормальных биоценозов женщины в сохранении ее здоровья невозможно отрицать, коррекция микрофлоры является важнейшим и необходимым компонентом в комплексе лечения различных заболеваний женской половой сферы.
Литература.
1. Д.С. Янковский. Микробная экология человека: современные возможности ее поддержания и восстановления. Киев, Эксперт ЛТД, 2005
2. В.И. Краснопольский. Патология влагалища и шейки матки. Москва «Медицина» 1997
3. П.С. Русакевич. Заболе6вания шейки матки. Минск, «Вышэйшая школа» 2000
4. Н.Б. Губергриц, Г.М. Лукашевич, Ю.А. Загоренко. Главный оппортунист нормальной кишечной флоры – Candida albicans. Современная гастроэнтерология, №4, 2005
Рубрика Влагалищные инфекции, Статьи и публикации






Отзывов нет
Комментариев пока нет.
Оставьте свой отзыв