С.И. Жук, Е.А. Ночвина
г. Винница
В процессе длительной эволюции природа сумела сформировать уникальное экологическое сообщество, состоящее из макроорганизма человека и заселяющих его открытые биологические системы многочисленных микробных популяций, число клеток которых в десятки-сотни раз превышает число собственных клеток тела человека. Этот специфический микробный орган выполняет колоссальное количество жизненно необходимых локальных и системных функций и является естественным регулятором взаимоотношений человека с экзогенным сообществом микроорганизмов.
Одной из ведущих проблем современной медицины является неуклонный рост числа больных, страдающих различными болезнями цивилизации: сердечно-сосудистые и онкологические болезни, гепатиты, ожирение, сахарный диабет, различные эндокринные патологии женской половой сферы. Тенденция к увеличению заболеваемости не снижается, а традиционные подходы к ее лечению больше не дают конструктивных идей. Это явилось одной из причин возросшего в последние десятилетия интереса к роли микроорганизмов, обитающих в организме человека, в поддержании его здоровья. Формирование качественного и количественного составов микрофлоры регулируется сложным механизмом межмикробных взаимодействий внутри каждой микроэкосистемы, а также контролируется физиологическими факторами организма – хозяина в динамике его жизни. Специфика расселения различных микробных популяций по отдельным биотопам макроорганизма корреллирует со сложившимися там условиями для обитания микроорганизмов. Наиболее густозаселенной экосистемой является толстая кишка – 60% микрофлоры, 15-16% в ротоглотке, 15-20% — кожные покровы, 9-10% в вагинальном биотопе. Центральным органом микроэкологической системы человека является так называемая приэпителиальная защитная биопленка, которая представляет собой слои слизи с имплантированными в нее колониями индигенной микрофлоры, ее метаболитами, молекулами S Ig A и другими защитными компонентам, синтезируемыми макроорганизмом и его микрофлорой. Именно защитная биопленка является мощным фактором противоинфекционной защиты. Она же выполняет ряд других важных фукнций, способствующих поддержанию гомеостаза организма: морфокинетическое действие, поддержание рН, продукция БАВ, детоксикация эндогенных и экзогенных субстратов, антимутагенная активность, участие в обмене белков, жиров, углеводов, нуклеиновых кислот, холестерина, ферментов, гормонов, иммуногенная роль — стимуляция синтеза иммуноглобулинов, интерферона, комплемента и т.д.
Спектр расстройств неинфекционной природы, причины развития которых все чаще связывают с дисбиозами различной локализации, непрерывно расширяются. Вызывают интерес наблюдения об участии микрофлоры в метаболизме эстрогенов и андрогенов. Микроорганизмы способны в различных вариантах реагировать со стероидными гормонами: вызывать их деконъюгацию, ароматизацию, эпимеризацию, восстанавливать кето- и гидроксигруппы, таким образом принимая участие в образовании активных метаболитов эстрогенов, при этом наиболее активное участие принадлежит анаэробам. В свою очередь половые гормоны способны изменять адгезивность микроорганизмов. Анализируя данный факт, можно сделать вывод о значении микрофлоры кишечника в физиологических механизмах циркуляции и выведения половых стероидных гормонов из организма.
При изменении состава микрофлоры кишечника создаются условия для неоднократной гепато-энтеральной циркуляции активных метаболитов, что оказывает существенное влияние на уровень гормонов в крови и способствует реализации эффекта пролонгированного действия эстрогенов.
Учитывая распространенность дисбиотических состояний, существует мнение, что нарушение качественного и количественного состава микрофлоры кишечника может индуцировать изменение уровня эстрогенов и прогестерона в сыворотке крови и других биологических жидкостях организма. Как следствие могут возникать различные нарушения оварио-менструального цикла, гормонозависимые новообразования молочных желез и яичников.
Таким образом, принимая во внимание взаимную зависимость дисбиотических расстройств микроэкосистемы макроорганизма и изменения состава и уровня половых стероидных гормонов, целью нашего исследования является изучение качественного и количественного состава микрофлоры кишечника и влагалища у женщин раннего репродуктивного возраста с нарушением оварио-менструального цикла.
Материалы и методы.
С целью решения поставленной задачи нами было обследовано 34 женщины раннего репродуктивного возраста, имеющих нарушение оварио-менструального цикла в виде предменструального синдрома (ПМС), альгодисменореи, дисфункциональных маточных кровотечений различного генеза, овуляторного синдрома. Для постановки диагноза использовались анкетно-анамнестический метод, общее гинекологическое обследование, измерение рН влагалища, тесты функциональной диагностики, определение уровня эстрадиола и прогестерона дважды на 5-7 день и 19-22 день цикла. Проводимое обязательное ультразвуковое исследование позволяло опосредованно изучить гормонопродуцирующую функцию яичников на основе изучения их морфологических характеристик (биометрия, состояние фоликулогенеза, качество и соотношение фолликулов и стромы).
Определение качественного и количественного состава микрофлоры влагалища и кишечника осуществляли микроскопическим и культуральным методом, путем посева влагалищных выделений и кала на питательные среды.
Таблица 1.
Состав нормальной микрофлоры толстокишечного биотопа.
|
Микроорганизмы |
Количество клеток микроорганизмов в 1 г содержимого толстой кишки |
|
Анаэробная ассоциация, % Bifidobacterium Lactobacillus Propionibacterium Бактероиды Peptostreptococcus Clostridium Eubacterium Аэробная ассоциация, % Еsherichia: - лактозосбраживающие - атипичные Enterococcus Staphylococcus Proteus Дрожжи и дрожжеподобные грибы |
95-97% 109- 1012 107-1010 107-1010 105-1010 105-106 102-105 105-107 3-5% 106-108 не более 103 105-107 103-105 не более 103 102-104 |
Таблица 2.
Нормальный состав вагинального нормобиоценоза женщин репродуктивного возраста.
|
Группа микроорганизмов
|
Количество клеток в 1 мл секрета |
|
Анаэробная микрофлора Lactobacillus Bifidobacterium Propionibacterium Clostridium Eubacterium Peptostreptococcus Бактероиды Peptococcus Veillonella Аэробная и факультативно- анаэробная микрофлора Corynebacterium Staphylococcus Streptococcus Esherichia Klebsiela |
108-109 105-107 104-106 не более 103 не более 103 103-104 не более 103 не более 103 не более 103 не более 103 103-104 104-105 103-104 не более 103 |
Результаты исследования и их обсуждение.
Средний возраст обследованных женщин 18-25 лет.
На наличие предменструального синдрома жаловались 30 женщин (88%). Пациентки указывали на 2-3 основных симптома (задержка жидкости, периферические отеки, увеличение массы тела, усиление аппетита, раздражительность, мастодиния и масталгия) за 2-5 дней до менструации, что расценивалось нами как легкая форма ПМС. Болезненные менструации имели место у 18 женщин (53%), дисфункциональные маточные кровотечения (межменструальное кровомазанье и кровотечение, меноррагия) беспокоили 6 женщин (18%), наличие овуляторного синдрома (боль в середине цикла) наблюдалось у 9 женщин (26%).
Таблица 3.
Структура нарушений оварио-менструального цикла у женщин (n=34)
|
Клинические симптомы |
Количество женщин |
|
|
абс.ч. |
% |
|
|
Предменструальный синдром Альгодисменорея ДМК Овуляторный синдром |
30 18 6 9 |
88 53 18 26 |
Наряду с вышеперечисленными жалобами 29 женщин указывали на наличие патологических выделений из влагалища, зуд, дизурию, диспареунию. При гинекологическом осмотре у этих женщин имели место незначительная гиперемия и отечность слизистой влагалища, белый гомогенный или творожистый налет. 26 из 34 женщин (76%) предъявляли жалобы со стороны желудочно-кишечного тракта, а именно ощущение распирания, спастические боли в животе, рецидивирующий анальный зуд, метеоризм, изменения в консистенции и частоте стула.
Нормальные показатели рН влагалища 3,5-4,6 имели место у 9 женщин (26%), 4,7-5,0 у 12 женщин (35%), 5,1-5,5 у 8 (24%), 5,6-6,0 у 3 женщин (8%), более 6,1 у 2 женщин (7%).
Таблица 4.
Уровень рН вагинального содержимого у исследуемых женщин (n=34)
|
Значение рН |
Количество женщин |
|
|
Абс.ч. |
% |
|
|
>6,1 |
2 |
7 |
|
5,6-6.0 |
3 |
8 |
|
5,1-5,5 |
8 |
24 |
|
4,7-5,0 |
12 |
35 |
|
<4,6 |
9 |
26 |
По тестам функциональной диагностики (базальная температура, симптом зрачка, длина натяжения цервикальной слизи) овуляция констатировалась у 24 женщин (70%), что подтверждалось ультразвуковым исследованием гениталий. По данным кольпоцитологических мазков установлено преобладание поверхностных клеток над парабазальными у 22 (65%) женщин, что свидетельствует об относительной эстрогенной насыщенности, при этом кариопикнотический индекс составлял 50-70%.
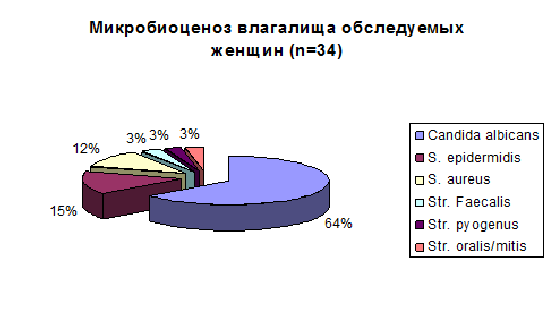
При определении уровня эстрадиола и прогестерона диагностирована относительная гиперэстрадиолемия. Микроскопический анализ мазков влагалищных выделений определил наличие ключевых клеток у 7 (20%) исследуемых женщин, что давало основание верификации диагноза бактериального вагиноза с учетом жалоб на наличие патологических выделений из влагалища, повышение рН. При микробиологическом исследовании влагалищных выделений у данных женщин наблюдалось снижение количества или отсутствие лактобацилл, возрастание колоний анаэробной флоры влагалища с преобладанием так называемых БВ-ассоциированых микроорганизмов (Gardnerella vaginalis, Mobiluncus sp.) У 22 (64%) женщин при микроскопии мазка обнаруживался мицелий грибов рода Candida. Культуральный метод исследования влагалищных выделений подтверждал наличие кандидозного вагинита. Параллельно у всех женщин диагностирован рост колоний факультативных аэробных микроорганизмов: S. epidermidis, S. aureus, Str. faecalis, Str. pyogenus, Str. oralis/mitis.
Диаграмма 1
При микробиологическом исследовании кала у 34 (100%) женщин диагностирован дисбактериоз 1-2 степени по микробным показателям, у 23(68%) с преобладанием дрожжевой флоры: молочно-белые колонии грибов рода Candida в количестве более 104 КОЕ/г, дефицит нормобиоты кишечника – облигатная E.сoli, бифидобактерии, лактобактерии.
На основании результатов проведенного исследования можно проследить изменения микробиоценоза кишечника и влагалища при дисгормональных расстройствах. В 100% случаев у обследуемых женщин на фоне нарушений оварио-менструального цикла диагностирован кишечный дисбиоз по микробиологическим характеристикам, причем у 68% с подавляющим ростом грибов рода Candida. В 85% случаев наблюдаются изменения нормобиоты влагалища, с преобладанием дрожжевой флоры у 64%.
Candida является условно-патогенной составляющей нормальной кишечной микрофлоры и может находится на поверхности слизистой желудочно-кишечного тракта не вызывая поврежедений. В качестве механизма развития кандидозного кишечного дисбиоза у обследуемых нами женщин можно рассматривать изменения гормонального статуса репродуктивной системы, который имеет определенное значение в стабильности показателей микробиоценоза. Половые гормоны могут воздействовать на этапе адгезии грибов, создавая условия, способствующие или препятствующие колонизации слизистой оболочки ЖКТ, а также регулировать качественный и количественный состав бактериальной флоры, влияя на эпителиоциты, грибы и микроокружение. Нормальный состав микрофлоры является одним из факторов стабильности экосистемы, обеспечивающий устойчивость эпителиоцитов к возможным воздействиям различных патогенных микроорганизмов, в том числе и Candida. В процессе адгезии грибы вступают в сложные биохимические взаимодействия с эндогенной микрофлорой. Многие бактерии тормозят их рост в культуре, снижают способность грибов колонизировать слизистую оболочку кишечника, вырабатывая антифунгальные вещества, а также конкурируя с ними за клеточные рецепторы.
Кандидоз, как проявление дисбиоза, является патологическим процессом, который первично локализируется в желудочно-кишечном тракте, а вторично в других областях, в частности в слизистой оболочке женских половых органов. У 22 женщин с диагностированным кандидозным вульвовагинитом по клиническим и микробиологическим показателям отмечалось наличие дисбиоза кишечника с преобладанием роста дрожжевой флоры. Этот факт доказывает транслокацию грибов в урогенитальный тракт из просвета кишечника, где представлена основная масса этих сапрофитов. Кандидоз внекишечной локализации, в частности урогенитальный, берет начало из кишечника.
Таким образом, мы рассматриваем кандидоз как изменения на уровне микробиоценоза кишечника, возникновение его дисбиоза, что тесно связано с нарушением обмена половых стероидов, где тот и другой патологический процесс являются звеньями одной патогенетической цепи. С одной стороны дисбаланс фукционирования эндокринной системы может вызывать изменения нормобиоты кишечника и влагалища, с другой – расстройства гормонального обмена как следствие наличия кишечного и вагинального дисбиоза.
Выводы
Исходя из результатов проведенного исследования, можно сделать вывод, что у женщин на фоне нарушений оварио-менструального цикла имеет место изменения качественного и количественного состава микрофлоры кишечника и влагалища с последующим возникновением условий для роста и реализации патогенных свойств сапрофитной микрофлоры. Данное состояние следует рассматривать в двух аспектах: с одной стороны нарушения баланса половых стероидов вызывает изменения микробного биотопа кишечника и влагалища, с другой – коррекция состава микрофлоры может оказывать влияние на регуляцию гормонального обмена.
Своевременное восстановление нормальной экосистемы макроорганизма может предупредить развитие патологии женской репродуктивной системы или повысить эффективность лечения. Принимая во внимание тесную взаимосвязь между различными биотопами организма человека и возможность обмена микрофлорой, необходимо обязательное параллельное восстановление вагинального и кишечного биоценоза.
В свете современных представлений о микрофлоре организма микробные объекты рассматриваются не как одноклеточные существа, а как компоненты колоний, представляющих аналоги многоклеточных организмов. Роль соединений, так называемых сигнальных молекул, синтезируемых микроорганизмами, в метаболизме различных биологически активных веществ достаточно не изучена. Известны факты про синтез микроорганизмами, в частности грибами рода Candida и Trichophyton, соединений, идентичных и аналогичных эстрогенам и прогестерону, которые могут непосредственно вступать в реакции метаболизма, инактивации и выведения половых стероидов. Также современная микробиология указывает на обнаружение специфических рецепторов с высоким сродством к половым гормонам (кортикостероид-связывающий белок и специфический рецептор, связывающий прогестерон у Candida albicans).
Таким образом, роль микрофлоры в регуляции обмена половых стероидов, значение микробной эндокринологии достаточно не изучены и требуют дальнейшего исследования с целью последующей адекватной коррекции гормональных рассторойств репродуктивной системы женщины.
Литература.
1. Н.Б. Губергриц, Г.М. Лукашевич, Ю.А. Загоренко. Главный оппортунист нормальной кишечной флоры – Candida albicans. Современная гастроэнтерология, №4 (24), 2005, стр. 99-106
2. Н.П. Елинов. Токсигенные грибы в патологии человека. Проблемы мед. микологии. Т.4, №4, 2002. стр. 3-7
3. Т.Ф. Татарчук, Я.П. Сольский. Эндокринная гинекология. Ч.1. К: Заповіт; 2003
4. М.Ф. Борисенков, А.П. Карманов. Гепато-энтеральная циркуляция половых стероидов. Россия. Сыктывкар.
5. Э.Л. Баркалова, В.Н. Романенко, И.В. Свистунов. Кандидозный вульвовагинит: некоторые аспекты патогенеза и нового подхода к лечению. Донецк.






1 отзыв
хорошая статья. пробиотики могут исправить проблему?
Оставьте свой отзыв