С.И. Жук, Е.А. Ночвина, Н.Б. Дзысь
Национальная академия последипломного образования им. П.Л. Шупика, г. Киев
Центр матери и ребенка, г. Винница
Винницкий национальный медицинский университет им. Н.И. Пирогова
Большинство женщин репродуктивного возраста в течение жизни инфицируются разными штамами ВПЧ, однако при этом для них является важным вопрос о выборе метода контрацепции. В данном обзоре описаны пути возникновения и прогрессирования эпителиальных неоплазий. Представлена связь инфицирования ВПЧ и дисгормональных нарушений (системных и локальных) с формированием патологического процесса.
Ключевые слова: вирус папилломы человека, дисгормональные нарушения.
Патология шейки матки – одно из часто встречающихся состояний в практике врача-гинеколога. Характерной особенностью данной патологии является то, что заболевания шейки матки диагностируются в любом возрасте и характеризуются длительным течением, определенной стадийностью и четкой взаимосвязью с цитологической картиной.
Развитие патологических процессов данной локализации может быть обусловлено различными причинами – вирусная и бактериальная инфекция, нарушение гормонального баланса, изменение биоценоза половых путей, травмы, разрывы и т.д. [1].
Первые исследования, посвященные эпидемиологии фоновых, предраковых процессов, а также рака шейки матки, появились еще в XIX в. Rigioni_Stern в 1842 г. опубликовал данные, основанные на изучении регистра смертей в г. Вероне с 1760 по 1830 г. Он заметил, что рак шейки матки значительно чаще был причиной смерти замужних женщин и вдов и не встречался у девственниц и монахинь. Это обстоятельство позволило ученому высказать гипотезу о раке шейки матки как инфекционном заболевании. При изучении 13000 историй болезни монахинь Монреаля и Квебека F. Ganon (1950) отметил, что рак шейки матки не был обнаружен ни разу.
До настоящего времени дискутируется вопрос о роли травмы, связанной с абортами и родами. Достаточно долгое время господствовало утверждение R. Meyer (1910) о травме как этиологическом моменте метапластических процессов в эпителии шейки матки. Однако в дальнейшем было установлено, что «не меньшее значение, чем механическая травма, в патогенезе рака шейки матки имеет местная инфекция, вернее сочетание этих двух условий» (А.И. Серебров).
В течение многих лет исследователями обсуждалась возможная связь дисплазии и рака шейки матки с вагинальной микрофлорой, которая представляет собой динамическую микроэкосистему и играет чрезвычайно важную роль в поддержании эпителия шейки матки на оптимальном уровне.
Изменения в составе нормальной генитальной микрофлоры способствуют снижению колонизационной резистентности и функциональной активности защитных барьеров организма по отношению к условно-патогенной микрофлоре, что может лежать в основе последующих патологических сдвигов, приводящих к дисплазии эпителия шейки матки [5].
Предметом дискуссии долгое время являлось влияние специфической микрофлоры на развитие патологических процессов шейки матки, включая трихомонадные инфекции и гарднереллез. Примеры такого влияния также обсуждались в отношении Treponema palliddum, Nisseria gonorrhoeae, Chlamydia trachomatis, вируса простого герпеса 2-го типа, ци томегаловируса, вируса папилломы человека [1].
Эпидемиологические исследования убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является генитальная папилломавирусная инфекция. При исследовании взаимосвязи ВПЧ и патологии шейки матки в 76% случаев было выявлено носительство онкогенных ВПЧ, при эктопии и/или эрозии шейки матки без клеточной атипии в 48% выявляется ВПЧ. При плоскоклеточной карциноме и цервикальной неоплазии ВПЧ присутствует в 100% случаев [8, 9,12].
ВПЧ – мелкие ДНК_вирусы, характерная особенность которых заключается в способности вызывать пролиферацию эпителия кожи и слизистых оболочек. Доказано существование более 130 типов, отличающихся по строению ДНК, 75 из них молекулярно клонированы. Типирование ВПЧ основано не на антигенных различиях, а на ДНК-гомологии. Среди 30 типов ВПЧ, которые поражают аногени тальную область, различают типы высокого и низкого он когенного риска. Как уже упоминалось, ВПЧ инфицирует эпителиальные ткани, что подтверждается обнаружением эписомального вирусного генома в клетках базального слоя эпителия. Жизненный цикл вируса тесно связан с диффе ренцировкой клетки-хозяина [1, 2]. Репликация вирусной ДНК и синтез капсидных белков вируса происходят в наиболее дифференцированных слоях эпителия. Вирус обладает целым набором механизмов, подчиняющих своим интересам жизнедеятельность инфицированной клетки. ДНК вируса кодирует синтез двух белков Е6 и Е7, которые индуцируют переход дифференцированных клеток в S-фазу клеточного цикла. На стадии активной репродукции вируса экспрессия генов Е6 и Е7 регулируется продуктом гена Е2, являющимся репрессором транскрипции этих генов.
Именно поэтому, пока вирус находится в эписомальном состоянии, наблюдаются доброкачественные процессы разрастания инфицированных тканей. Ключевым моментом в малигнизации клеток является интеграция вируса в геном клеток, которая сопровождается делецией гена Е2 [4, 6, 14] (рис. 1).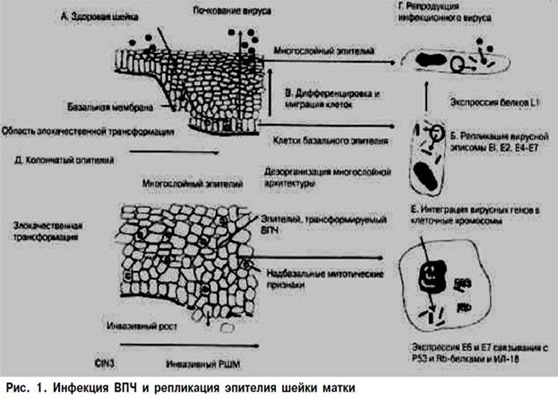
Указанные процессы в дальнейшем вызывают следующий каскад изменений: в эпителиальных клетках с интегрированной формой ВПЧ регистрируется сверхэкспрессия генов Е6 и Е7, так как в процессе интеграции утрачивается ген Е2, кодирующий репрессор транскрипции этих генов. Любые противовирусные препараты бессильны остановить процесс опухолевой трансформации, так как инфицированные клетки не содержат вирус в традиционном понимании, и все лечебные мероприятия должны быть направлены на элиминацию клеток с интегрированной формой генома ВПЧ. Контроль клеточного цикла и дифференцировка клеток осуществляется белками Е6 и Е7 посредством их взаимодействия и инактивации таких «ключевых» белков – регуляторов пролиферативной активности клеток, как р53 и белок ретинобластомы (pRB) [1, 4, 6, 14]. Бесконтрольная пролиферация инфицированных клеток приводит к накоплению генетических повреждений и в конечном счете – к малигнизации (рис. 2). Число инфицированных ВПЧ точно не известно. При массовых исследованиях ВПЧ обнаруживают у 40–50% молодых женщин, но в большинстве случаев вирус спонтанно исчезает, лишь у 5–15% он вызывает хроническую инфекцию шейки матки, реже – вульвы и влагалища. По данным различных литературных источников, ДНК вируса обнаруживают у 10–15% женщин в шейке матки при нормальных результатах цитологического исследования и в 91–92% – при патологических данных. На каждый 1 млн женщин с какой-либо папилломавирусной инфекцией у 100 000 возникает цервикальная интраэпителиальная неоплазия, у 8000 – CIN III и карцинома in situ и у 1600 – инвазивный рак шейки матки [4, 6, 14, 17].
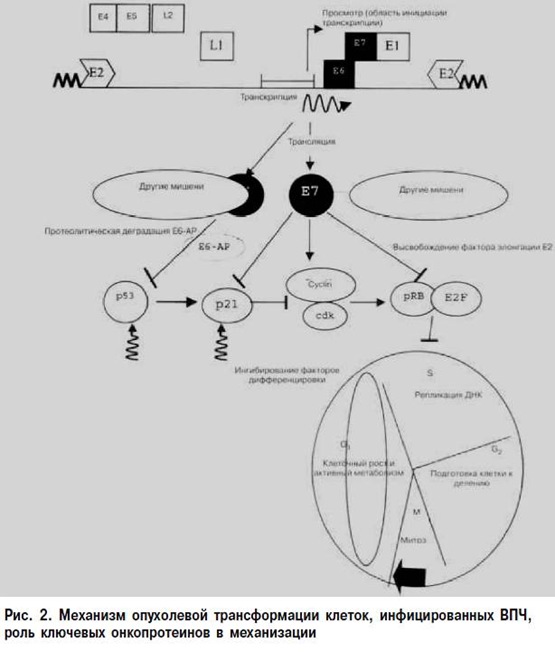
Поскольку ВПЧ_инфекция достаточно широко распространена среди здоровых женщин, очевидно, что для прогрессии процессов малигнизации необходимы дополнительные эпидемиологические факторы. В связи с этим многие авторы приходят к выводу, что инфицирование эпителиальных клеток ВПЧ – необходимое, но недостаточное событие для ракового перерождения.
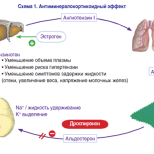
В настоящее время в литературе широко обсуждаются различные гормональные нарушения в генезе предраковых заболеваний шейки матки. По данным разных авторов, одним из факторов развития фоновых и предраковых заболеваний шейки матки следует считать гормональный дисбаланс, который появляется задолго до возникновения первых клинических проявлений патологических процессов данной локализации. Так, нарушения овариально_менструального цикла по типу ановуляции, недостаточность лютеиновой фазы, гиперполименоррея встречаются у 72–80% данного контингента больных [5].
Еще в 1947 г. один из крупнейших онкоморфологов М.Ф. Глазунов указал на дисгормональную природу эктопии шейки матки. В 50-х годах ХХ века H. Burrows и E. Horing высказали предположение, что влияние эстрогенов (в том числе и в физиологических концентрациях) на опухолевой рост связано с усиленным митогенезом. В 90-х годах опубликованы данные исследований, подтверждающие роль абсолютной или относительной гиперэстрогении в генезе лейкоплакии шейки матки. Отмечено прогрессирование степени неоплазии шейки матки на фоне гиперэстрогении. Установлено также, что при длительной эстрогенной депривации эстрогеновые рецепторы меняются качественно, становясь более чувствительными к эстрогенам, в то же время обеспечивая селективную активациию определенных генов.
Для того чтобы понять роль эстрогенов в развитии неопластических процессов в так называемых эстрогенчувствительных тканях, в частности шейки матки, необходимо рассмотреть, как происходит метаболизм женских половых гормонов в организме женщины [1, 17].
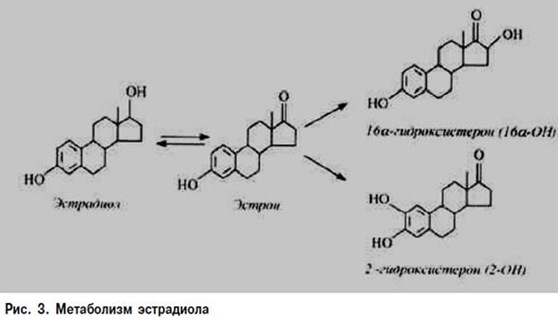
На первом этапе ферментативная система цитохрома Р-450 обеспечивает конверсию эстрадиола – самой активной фракции женских половых гормонов – в два основных метаболита: 16а_гидроксистерон (16а-ОН) и 2-гидроксистерон (2-ОН) (рис. 3).
Наиболее предпочтительным для женщины является 2-ОН. Этот метаболит обладает слабым эстрогеновым действием (примерно 48% активности эстрадиола) и поэтому не оказывает пролиферативного действия на клетки. В отличие от 2-ОН 16а-гидроксиэстроген является более активным метаболитом, в 8 раз превышающим активность эстрадиола, и относятся к категории «агрессивных гормонов». Высокая скорость их образования в организме вызывается и поддерживается состоянием гиперэстрогенемии. Снижение соотношения 2-ОН к 16а-ОН является свидетельством высокого риска канцерогенеза в эстрогенчувствительных тканях. Существует еще один путь превращения эстрадиола с образованием 4-гидроксистеронов. Несмотря на их низкую активность (примерно 79% активности эстрадиола), они могут повреждать ДНК клетки и вызывать ее раковое перерождение.
После прохождения первого этапа превращения в 2-ОН и 4 ОН гидроксиметаболиты женских половых гормонов могут превратиться или в семихиноны – соединения, которые обладают генотоксическим действием, или с помощью метилирования – в 2 и 4-метоксиэстрогены – соединения, абсолютно безвредные для организма [4, 6, 14, 17].
Во многих работах по онкоэндокринологии встречается понятие гормонального канцерогенеза как механизма образования неопластических процессов в гормонозависимых тканях. На протяжении нескольких десятилетий формировалась точка зрения о так называемом промоторном, или физиологическом, типе гормонального канцерогенеза, когда действие гормонов сводится к роли своеобразных кофакторов, усиливающих клеточное деление (стадию промоции). С развитием новых технологий (с изучением так называемых аддуктов – комплексов ДНК с соответствующими соединениями, в том числе и гормональной природы) в опытах in vivo характер получаемых результатов и выводов начал меняться. Именно изучение способности метаболитов классических эстрогенов, в частности 2_ и 4_гидроксиэстрадиола, вызывать повреждение ДНК клетки послужило «толчком» к открытию оригинальной концепции генотоксического типа гормонального канцерогенеза. Суть теории такова: классические эстрогены могут в той или иной степени превращаться в катехолэстрогены, которые вовлекаются в реакции обменно_восстановительного цикла с образованием хинонов, семихинонов и других свободнорадикальных метаболитов, способных повреждать ДНК, формировать ее аддукты, приводить к мутациям, а значит, инициировать неопластическую трансформацию [5].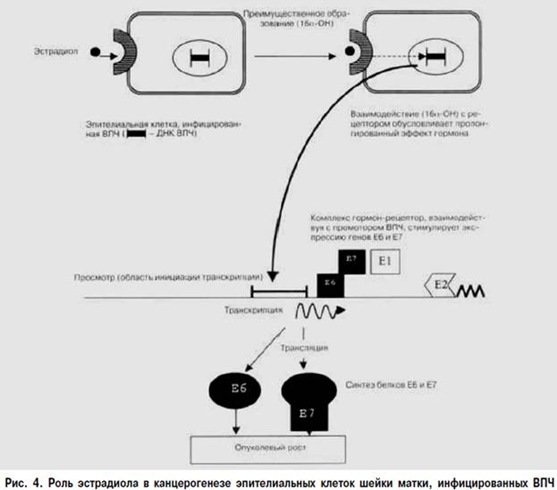
Итак, как упоминалось ранее, инфицирование эпителиальных клеток ВПЧ является необходимым, но недостаточным фактором для развития фоновых, предраковых процессов и рака шейки матки. Вирусная инфекция имеет гормонозависимый характер, и если в организме происходит гормональный сбой, ВПЧ получает свой шанс. Давно было отмечено, что тканевые изменения в цервикальном канале, вызванные ВПЧ, локализованы главным образом в эстрогенчувствительных зонах. В эпителиальных клетках с интегрированной формой ВПЧ отмечается повышенная экспрессия генов Е6 и Е7, кодирующих онкобелки Е6 и Е7. Было установлено, что там, где наблюдается активная экспрессия белков ВПЧ, отмечен высокий уровень 16а_ОН. Репродукция ВПЧ индуцирует образование агрессивного метаболита эстрадиола в инфицированных клетках, который обладает самостоятельной канцерогенной активностью, что создает дополнительные условия для злокачественного перерождения клеток, содержащих ВПЧ [1].
Таким образом, механизм формирования необратимой неоплазии следующий: после взаимодействия эстрадиола с эстрогеновыми рецепторами ВПЧ-инфицированной клетки происходит изменение его метаболизма в сторону образования 16а_гидроксистерона, который в свою очередь способен образовывать очень прочный комплекс с эстрогеновым рецептором (ER – 16a-OH). Этот комплекс является мощнейшим активатором генов Е6 и Е7, ответственных за синтез онкобелков Е6 и Е7, что ведет к развитию опухолевого роста (рис. 4). В результате формируется порочный круг, при котором вирус через образование 16а-ОН создает благоприятные условия для развития опухоли, стимулируя синтез онкобелка Е7. В свою очередь онкобелок активирует механизмы патологической пролиферации и блокирует механизмы иммунологической защиты. Биологический смысл этих событий состоит в том, что формирующаяся опухоль использует все возможности для поддержания собственного роста [1, 2, 11].
Из этой модели очевидно, что для лечения и профилактики фоновых, предраковых процессов шейки матки, а также для предупреждения возможной малигнизации в дальнейшем необходимо разорвать этот патологический механизм.
В связи с появлением гормональной концепции цервикального канцерогенеза на фоне ВПЧ-инфицирования принципиально изменились и подходы к лечению фоновых и диспластических процессов эпителия шейки матки. В настоящее время хирургическое методы стали играть второстепенную роль, а на первое место вышла этиопатогенетическая терапия. Это обусловлено тем, что процент рецидивов после использования деструктивных методов достаточно высок.
Причина заключается в том, что в случае хирургического лечения иссекается только видимый патологический очаг, а не этиологический фактор [1, 2].
Еще в 1986 г. Я.В. Бохман сформулировал общие принципы лечения фоновых заболеваний шейки матки: оно должно предусматривать ликвидацию этиологического фактора и тех воспалительных, дисгормональных, иммунодепрессивных и дисметаболических изменений в организме, которые способствуют его возникновению и поддержанию длительного течения [4, 15, 16].
В настоящее время этиопатогенетическая терапия патологии шейки матки имеет два основных направления – воздействие на этиологический фактор – вирус папилломы человека и блокирование основных механизмов канцерогенеза, а именно гормонального канцерогенеза, связанного с повышенным образованием агрессивного метаболита эстрадиола – 16а_ОН на фоне гиперэстрогенемии и ВПЧ-инфицирования.
Ликвидация дисбаланса женских половых гормонов, существующего при различных нарушениях овариально-менструального цикла, способствует нормализации метаболизма эстрадиола в клетках, инфицированных ВПЧ, препятствует образованию канцерогенного 16а-ОН, снимая тем самым эстрадиолзависимую индукцию онкогена Е7. В результате происходит резкое снижение уровня экспрессии онкобелка и препятствие гормонозависимой пролиферации инфицированных клеток [1–3, 10, 11].
Проблема гормонального лечения женщин с нарушением овариально_менструального цикла, несмотря на длительную историю гормонотерапии, продолжает оставаться в центре внимания отечественных и зарубежных исследователей. В литературе широко дискутируются различные аспекты применения при гормональных нарушениях комбинированных гормональных контрацептивов как с целью контрацепции так и с целью получения терапевтических неконтрацептивных эффектов, большинство из которых является следствием подавления овуляции и устранения колебаний уровня половых гормонов в организме женщины, что является причиной некоторых видов патологии овариально-менструального цикла. Положительные неконтрацептивные эффекты комбинированных гормональных препаратов представлены двумя группами: лечебные эффекты (уменьшение или устранение патологических симптомов), которые обычно присутствуют у женщин как дополнительные положительные свойства гормональных контрацептивов, а также могут быть использованы самостоятельно при назначении препарата, и защитные эффекты (снижение риска некоторых заболеваний).
Комбинированные оральные контрацептивы (КОК) лидируют среди методов планирования семьи как наиболее распространенные в мире (около 100 млн женщин сегодня применяют их постоянно). Именно благодаря совершенствованию гестагенного компонента и снижению содержания этинилэстрадиола с комбинированными оральными контрацептивами (КОК) связаны все более значимые лечебно-профилактические эффекты. Особое внимание заслуживают онкопротекторные свойства КОК: снижение рака яичников и эндометрия на 50–80%, колоректального рака – на 40–50%, хорионэпителиомы – на 100%, доброкачественных заболеваний молочной железы – на 40%. Проведенные исследования на основе многолетнего опыта использования КОК в мире доказали лечебные и профилактические эффекты оральных контрацептивов при эндометриозе, миоме матки, дисфункциональных маточных кровотечениях и гиперпластических процессах эндометрия, предменструальном синдроме, патогенетической основой которых является гиперэстрогенемия [18].
Применение таблетированных КОК при ВПЧ-ассоциированных заболеваниях шейки матки блокирует звенья вирусного и гормонального канцерогенеза путем нормализации стероидного баланса, тем самым препятствуя образованию агрессивного метаболита эстрадиола 16а_ОН, который вступает в прочную связь с эстрогеновыми рецепторами эпителиальных клеток шейки матки, инфицированных ВПЧ, и вызывает их бесконтрольную пролиферацию. Нормальный уровень эстрогенов обеспечивает конверсию эстрадиола в 2_ОН, который обладает умеренной функциональной активностью и, в отличие от 16а-ОН, нормализует клеточный рост [12, 14].
Согласно медицинским критериям ВОЗ приемлемости при принятии решения об использовании препарата при фоновых заболеваниях шейки матки, КОК относят к классу 1, т.е. к таким препаратам, которые не имеют ограничения при применении. При раке и предраковых состояниях данной локализации КОК имеют значительные преимущества для здоровья и не считаются фактором риска возможных осложнений (класс 2). Детальный анализ литературы за последние 10 лет показывает, что частота возникновения рака шейки матки у женщин, применявших КОК, не превышает таковой в популяции. Проведенные исследования о влиянии КОК на состояние экто- и эндоцервикса у женщин с эктопией свидетельствуют об отсутствии отрицательного воздействия КОК на эпителий шейки матки [8].
В настоящее время применение КОК является важным компонентом в комплексном лечении и профилактике фоновых и предраковых заболеваний шейки матки, и самое главное – в выборе метода контрацепции у женщин, которые инфицированы ВПЧ, при отсутствии клинических проявлений на шейке матки. Выбор метода контрацепции не должен усугубить или спровоцировать в будущем активацию ВПЧ.
Так как одной из составляющих патогенеза указанной патологии служит гормональный дисбаланс, в результате гиперэстрогения приводит к усилению клеточного деления и совместному генотоксическому действию эстрогенов и ВПЧ.
ВПЧ индуцирует образование агрессивного метаболита эстрадиола в инфицированных клетках, который обладает самостоятельной канцерогенной активностью, что создает дополнительные условия для злокачественного перерождения клеток, содержащих ВПЧ. Все эти процессы происходят задолго (ни за один год, а на протяжении 3–5 лет и больше) до первых клинических проявлений патологического процесса.
Эстрогены (даже кратковременное действие гормона и его метаболитов) могут служить пусковым механизмом для манифестации латентной формы ВПЧ_инфекции. Таблетированные КОК способны нормализовать изменения в гипоталамо-гипофизарной системе, устранить гиперэстрогению, нормализовать процессы в эпителии, и в данном случае пероральный прием препаратов будет иметь преимущество перед вагинальным [1, 2, 9, 15].
Согласно медицинским критериям преемственности методов контрацепции ВОЗ (третье издание), эти формы выпуска не имеют пока большой доказательной базы, подтверждающей преимущество вагинального и трансдермального пути введения над пероральным. Вагинальные кольца и пластыри не отличаются по основному механизму действия от таблетированных КОК. Именно поэтому пластыри, вагинальные гормональные кольца имеют такие же показания, противопоказания, риски применения, как и таблетированные КОК, о чем сказано в инструкциях к данным препаратам. Пока еще рано говорить о преимуществах вагинального и трансдермального пути введения гормональных субстанций над таблетированными КОК, так как не опубликованы и необобщены результаты различных исследований ВОЗ и не даны дополнительные рекомендации [18].
На данный момент таблетированные КОК изучены больше, чем вагинальные кольца и пластыри. Одним из преимуществ введения гормонов, минуя пищеварительный тракт, считается быстрое проникновение активного вещества в кровоток. Местное действие эстрогенов и прогестинов требует дальнейшего тщательного изучения. Поэтому важно учитывать пути введения гормональных веществ (особенно синтетических, ненатуральных эстрогенов) в составе контрацептивов [1].
На сегодняшний день в литературе обсуждается вопрос о метаболизме этинилэстрадиола во влагалище и участие в нем специфических энзимов. До настоящего времени нет ясности в вопросе о способности влагалищного эпителия аналогично другим органам метаболизировать местно введенные эстрогены в 16а-, 2- и 4-гидроксилированные метаболиты, которые вступают во взаимодействие с эстрагеновыми рецепторами влагалища и шейки матки, включаясь в процессы пролиферации эпителиальных клеток. Некоторые литературные данные указывают на то, что ткани влагалища и шейки матки обладают способностью дальнейшего метаболизирования этинилэстрадиола преимущественно по пути 16а-гидроксилирования с образованием агрессивного метаболита, в результате чего запускается каскад белковых реакций в сторону патологического деления клеток, особенно у женщин, инфицированных ВПЧ [19]. Распространенность ВПЧ чрезвычайно велика, и в гениталиях тот или иной тип ВПЧ присутствует у 40–80% обследованных, однако клинически выраженные поражения бывают у 1–3%, субклиническое течение наблюдается у 13–34%, а в остальных случаях имеется латентная форма. Учитывая такую большую распространенность ВПЧ среди здоровых женщин, а также принимая во внимание указанный путь метаболизма этинилэстрадиола тканями влагалища и шейки матки, вагинальный путь введения комбинированного гормонального котрацептива как с целью контрацепции, так и для получения лечебного эффекта при дисгормональных расстройствах вызывает некоторые опасения развития или усугубления уже существующей патологии шейки матки. В литературе имеются данные лишь о годичном применении влагалищного гормонального кольца с анализом его влияния на шейку матки, хотя общеизвестно, что процесс развития рака шейки матки является многостадийным и может занимать от 3 до 10 лет [15, 17].
Также на данный момент не исследовано влияние синтетических гормонов на эпителий головки полового члена, которое происходит во время полового акта (синтетический эстрадиол не является «естественным» гормоном для эпителия полового члена) [19].
Дисскусионным на сегодняшний день является вопрос касающийся метаболизма гормонов в печени при использовании трансдермального и вагинальных форм введения гормональных веществ. Именно поэтому в инструкциях к применению показания и противопоказания таблетированных форм КОК, вагинальных колец, пластырей, содержащих гомональные вещества, не отличаются.
ВЫВОДЫ
Таким образом, на сегодняшний день причины возникновения и развития патологии шейки матки остаются важной проблемой в современной гинекологии. Применение таблетированных КОК в сочетании с противовирусной терапией является перспективным направлением в формировании тактики и стратегии как консервативного, так и оперативного лечения заболеваний шейки матки. Блокируя звенья вирусного и гормонального канцерогенеза, комбинированные оральные контрацептивы оказывают терапевтическое действие и повышают эффективность интерферонотерапии. Применение индивидуально подобранного гормонального лечения дает возможность значительно повысить эффективность комплексного лечения фоновых и предраковых процессов шейки матки.
Дискусійні питання методів контрацепції в жінок із фоновими захворюваннями шийки матки
С.І. Жук, Є.А. Ночвіна, Н.Б. Бзись
Більшість жінок репродуктивного віку впродовж життя інфікуються різними штамами ВПЛ, однак при цьому для них важливим є питання вибору методу контрацепції. У даному огляді описано шляхи виникнення та прогресування епітеліальних неоплазій. Представлено зв’язок інфікування ВПЛ і дисгормональних порушень (системних і лакальних) із формуванням патологічного процесу.
Ключові слова: вірус папіломи людини, дисгормональні порушення.
ЛИТЕРАТУРА
1. Киселев В.И., Ашрафян Л.А., Кулаков В.И., Прилепская В.Н. и сооавт. Этиологическая роль вируса папилломы человека в развитии рака шейки матки: генетические и патогенетические механизмы, возможности терапии и профилактики // Гинекология. – 2004. – Т. 6, № 4.
2. Волошина Н.Н., Кузнецова Т.П., Шатовский Ю.А. Противовирусное лечение больных с цервикальной интраэпителиальной неоплазией и преинвазтвным раком шейки матки // Репродуктивное здоровье женщины. – 2007. – № 5 (34). – С. 51–53.
3. Потапов В.О., Стрельцова Т.Р. Особенности иммунного статуса у женщин, инфицированных вирусом папилломы человека, которые используют оральную контрацепцию // Репродуктивное здоровье женщины. – 2007. – № 4 (33). – С. 150–152.
4. Заридзе Д.Г.. Эпидемиология, механизмы канцерогенеза и профилактики рака // Здоров’я України. – 2004. –№ 103.
5. Берштейн Л.М.. Гормональный канцерогенез // Природа. – 2000. – № 3.
6. Куценко С.А. Основы токсикологии: Гл. 6.3. Химический канцерогенез. – СПб, 2002.
7. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. – М.: Гэотар Медиа, 2005.
8. Киселев В.И., Киселев О.И. Вирусы папилломы человека в развитии рака шейки матки. – СПб. – М.: Роза мира, 2003.
9. Кулаков В.И. и соавт. Современные подходы к диагностике папилломавирусной инфекции гениталий женщин и их значение для скрининга рака шейки матки // Гинекология. – 2000. – № 1 (2). – С. 4–8.
10. Franko E.L., Villa L.L., Richardson H., Roman T.E. Epidemiolody of Cervical Human Papillomavirus Infecsion. In Franco E.&Mosonego J., editors. New Dtvtlopments in Cervical Cancer Screening and prevention. Oxvord Blecwell Science 1997. – P. 14–22.
11. Ван Крог, Лейси Д., Гросс Г. и др. Европейский курс по заболеваниям, ассоциированным с ВПЧ: рекомендации для врачей общей практики по диагностике и лечению аногенитальных бородавок // ЗППП. – 2001.
12. Gross G.E. & Barrassso R. Human Papilloma Virus Infection. A Clinical Atlas, 1997.
13. Sach K.V., Kessis T.D., Sach Fetal. Human papillomavirus investigation of patients with cervical intraepithelial neoplasia 3, some of whom progressed toinvasive cancer// Int J Gynecolog Pathol, 1996.
14. Ferguson A.W., Svoboda Nevman S.M., Frank T.S. Analisis of human papillomavirus infection and molecular alterations in adenocarcinoma of cervix. – Mod Pathol, 1998.
15. Cox J.Е., Lorincs A.T., Shiffman M.H. et al. Human papillomavirus testing by gybrid capture appears to be useful in triaging women with a cytologic diagnosisjf atypical squamous cell of undetermined significans // Am J obstet Gynecol, 1995.
16. Hall S., Lorins A., Shah F. et al. Нuman papillomavirus DNA detection in cervical specimtns by Hybrid Capture correlation with cytology and hystologic diagnosis of squamous intraepithelial lesions of cervics // Gynecol Oncol, 1996.
17. Muti P. Estrogen metabolism and risk of breast cancer: a prospective study of the 2:16 alphahydroxyestrone ratio in premenopausal and postmenopausal women // Epidemiology Nov. 2000. 11 (6): 635–406.
18. Медичні критерії прийнятності використання методів контрацепції. Видання третє, 2004р. Всесвітня організація охорони здоровя, Женева. – Репродуктивне здоров’я та дослідження.
19. Балан В.Е., Великая С.В., Тихомирова Е.В.. Принципы заместительной гормонотерапии урогенитальных расстройств // Consilium Medicum. – 2002. – Т. 4/N 7.
Рубрика Контрацепция, Статьи и публикации






1 отзыв
Добрый день! Большое спасибо за очень интересную и полезную для практической ежедневной работы врача акушера-гинеколога статью.
Оставьте свой отзыв